Assimilat Allokation und NMR
Ziel unserer Arbeiten ist es, neue Erkenntnisse über das Zusammenwirken von Metabolittransport, Stoffwechsel und Samenbau zu erlangen, und somit Grundlagen für die Verbesserung ertragsbezogener Eigenschaften von Kulturpflanzen zu legen.
Wir erforschen das Wachstum von Samen einschließlich physiologischer Prozesse (Transport von Assimilaten, Musterbildung, Speicherung). Hierfür betrachten wir den pflanzlichen Samen als lebendes Multiorgansystem, dessen Funktionalität auf Interaktion beruht. Derzeitige Omics-Technologien zerlegen die lebende Pflanze in tausende Bestandteile, während wir deren orchestrierende Ausprägung in vivo untersuchen.
Wir entwickeln topographische, in vivo Ansätze zur Identifikation von Schlüsselfaktoren, welche Assimilataufnahme und Metabolitverteilung zwischen Lipiden, Proteinen und Stärke im sich entwickelnden Samen steuern. Bevorzugte Forschungsmodelle sind Getreide (Weizen, Gerste) und Ölpflanzen (Raps).
Unsere Herangehensweise stellt physiologische Aspekte in den Mittelpunkt, und nutzt insbesondere neuartige, zerstörungsfreie und bildgebende Verfahren, basierend auf Kernspinresonanz, Infrarotspektroskopie und Photosensorik. Diese werden durch klassische, bioanalytische Verfahren wie Massenspektrometrie sowie molekularbiologische Methoden ergänzt.
scroll top
Projekte
Wir untersuchen die Entwicklung und Eigenschaften von Samen, insbesondere die Aufnahme von Assimilaten sowie deren Stoffwechsel in sich entwickelnden Samen. Hierfür verwenden wir Magnetresonanztomografie and weitere analytische Verfahren. Die bevorzugten Pflanzenmodelle sind Kulturpflanzen wie Gerste, Weizen, Mais und Raps. Zudem entwickeln wir spezielle Anwendungen für Arabidopsis, Zuckerrübe und andere Pflanzen, welche im Rahmen von Kooperationen bearbeitet werden.
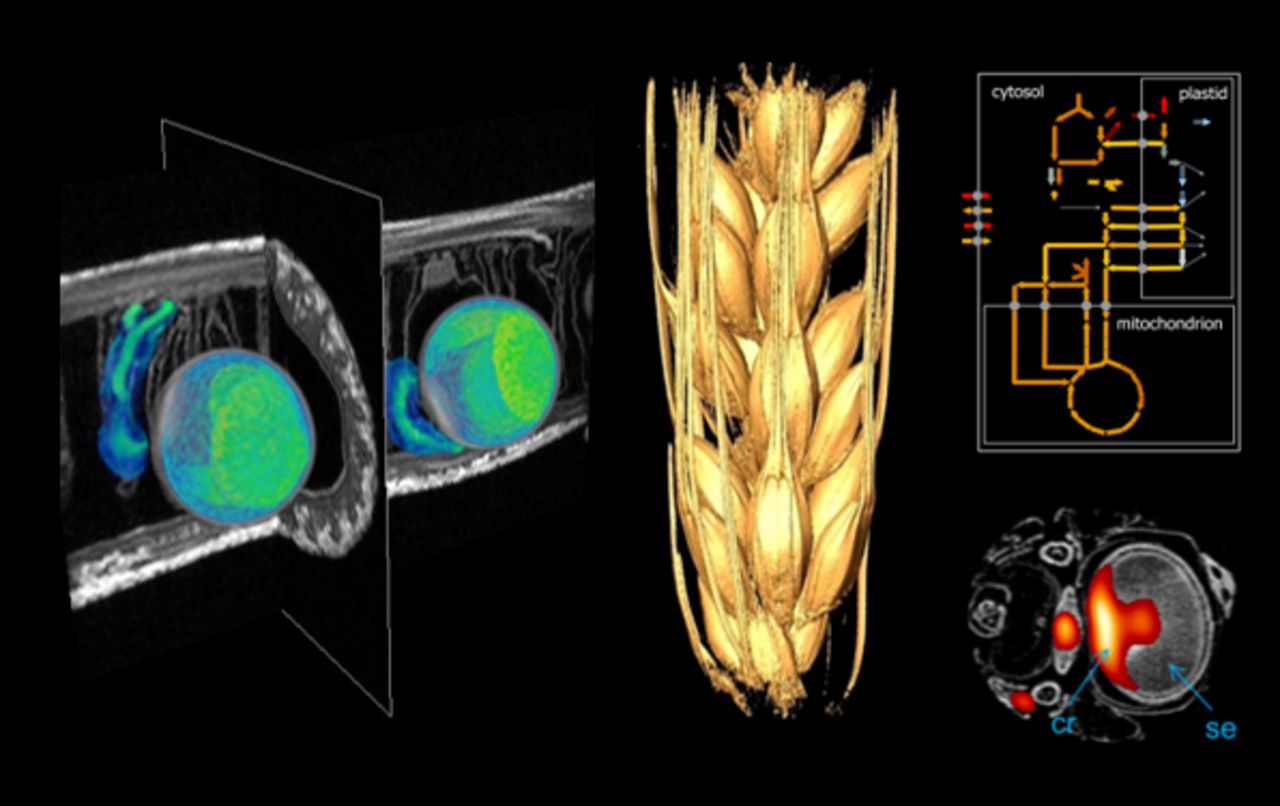
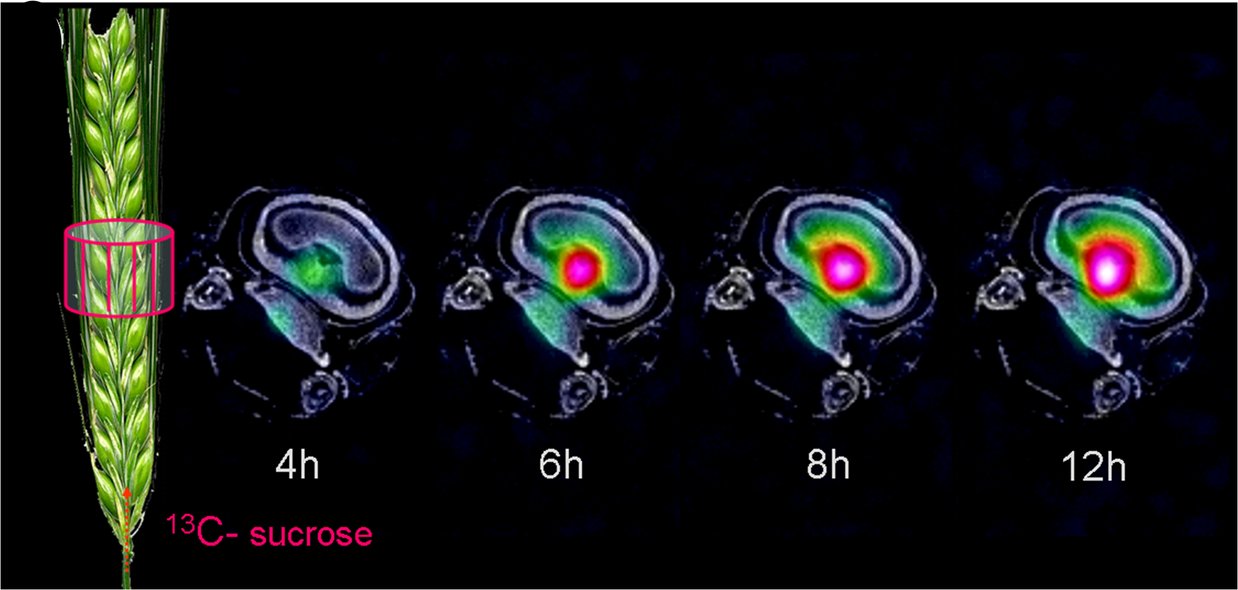
Die Mechanismen der Assimilatversorgung von sich entwickelnden Samen sind von höchster Relevanz für unsere Forschung an Kulturpflanzen. Der eigentliche Transportweg der Assimilate ist vor dem menschlichen Auge versteckt und für in vivo Analysen schwer zugänglich. Wir haben daher nicht-invasive Visualisierungstechniken entwickelt. Basierend auf Kernspinresonanz (NMR) können wir den Saccharosetransport von Source (Blatt) zu Sink (Same) visualisieren und den Zuckertransport im lebenden Samen untersuchen.
Diese und weitere Verfahren liefern Informationen zu den am Transport beteiligten Geweben, und der raumzeitlichen Dynamik des Assimilatimportes durch den Samen. Entwicklungs- und Transportprozesse in Samen werden auch auf molekularer und biochemischer Ebene charakterisiert. Hierfür nutzen wir Massenspektrometrie, Infrarot-Spektroskopie und andere biochemisch-analytische Verfahren sowie metabolische Modellierung. Dieser integrative Ansatz erlaubt uns eine umfassende Charakterisierung von für die Samenfüllung relevanten Prozessen (Melkus et al., Plant Biotechnology Journal 2011; Rolletschek et al., Plant Cell 2011; Borisjuk et al., Plant Journal 2012; Rolletschek et al., Plant Physiology 2015, Munz et al., New Phytologist 2017; Radchuk et al., J Exp Bot 2017).
In laufenden DFG-finanzierten Projekten untersuchen wir zum Beispiel die Rolle von spezifischen Zuckertransportern (SUT-, SWEET-Genfamilien) für die Samenentwicklung in Getreiden.
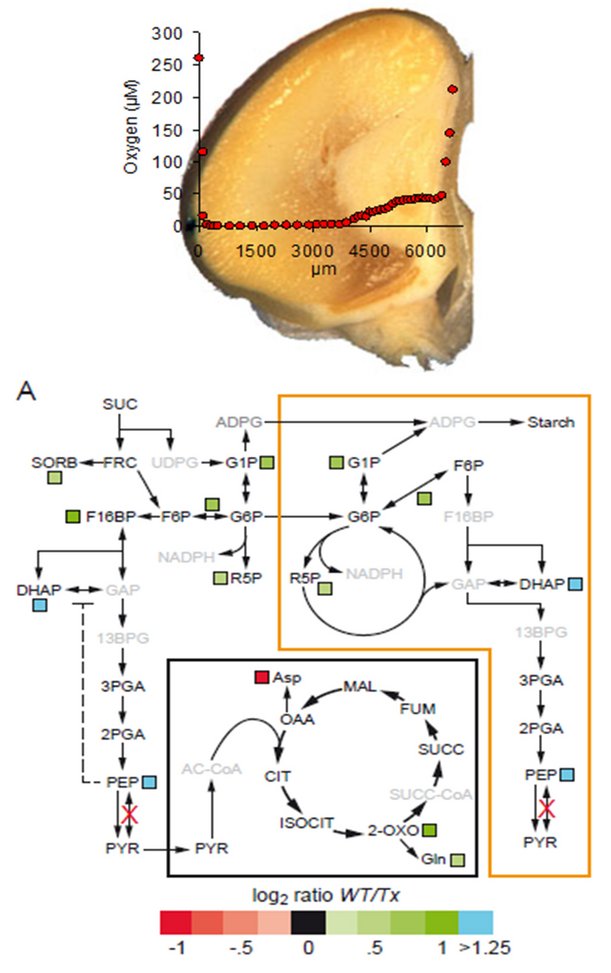
Hypoxie bezeichnet eine Mangelversorgung des Gewebes mit Sauerstoff. Hierzu kommt es, wenn die Sauerstoffversorgung (über Diffusion) limitiert ist, und somit die Konzentration unter ein bestimmtes Niveau fällt. Ab diesem Mindestniveau wird der zelluläre Stoffwechsel beeinträchtigt. Dieser hypoxische Zustand wird in sich entwickelnden Samen vieler Kulturpflanzen regelmäßig erreicht (siehe auch die Habilitationsarbeit von Dr. H. Rolletschek (2012) “Hypoxia – a phenomenon which shapes seed metabolism”. Naturwissenschaftliche Fakultät, Leibniz Universität Hannover/Deutschland). In Samen tritt Hypoxie wegen erhöhter Respirationsraten bei gleichzeitig sehr hoher Kompaktheit des Samengewebes (geringe Porosität und Tortuosität) auf. Letzteres führt zu stark eingeschränkter Sauerstoffdiffusion innerhalb des Samengewebes (Verboeven et al., New Phytologist 2013).
In laufenden, DFG-finanzierten Projekten untersuchen wir den Einfluss von endogener Hypoxie auf Assimilataufnahme und Metabolismus von sich entwickelnden Maiskörnern. So arbeiten wir zu spezifischen metabolischen Enzymen (PPDK; Lappe et al., PNAS 2018), an der metabolischen Heterogenität des Endosperms (Rolletschek et al., 2017 In: Maize Kernel Development), an Phytoglobin-Proteinen und anderen signalling-Komponenten.
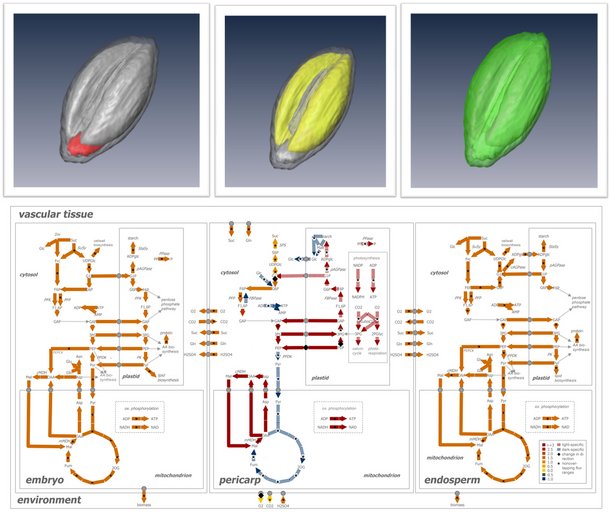
Ein Grundgedanke unserer Forschung ist, dass metabolische Aktivitäten (Fluxe) lokal reguliert werden und mit der Samenarchitektur verbunden sind. So entsteht in den Samen von Getreiden (Gerste, Weizen) durch die räumliche Struktur und Isolation maternaler und filialer Gewebe ein metabolisch komplexes, interaktives System bestehend aus Perikarp, Endosperm und Embryo. Gleichzeitig sind diese Organe autonom - folgen also ihren eigenen, genetischen Programme. Um den Stoffwechsel und das Wachstum des Gesamtkorns zu verstehen, muss man den organ-spezifischen, metabolischen Beitrag der einzelnen Organe untersuchen. Zu diesem Zweck führen wir räumlich-aufgelöste, molekulare, biochemische und physiologische Analysen zum Stoffwechsel durch, einschließlich metabolischer Modellierungsansätze.
Neuere Untersuchungen an Gerstenkörnern zeigten z.B. durch welche Mechanismen das Korn seine C-Bilanz optimiert, und das trotz umweltbedingter Schwankungen in der Assimilatversorgung eine metabolische Homöostase erreicht werden kann (Rolletschek et al., Plant Physiology 2015).
In den Ölsamen von Raps (Brassica napus) konnten wir zeigen, dass während der Entwicklung starke, lokale Unterschiede in der Ölakkumulation auftreten (Borisjuk et al., Progress Lipid Research 2013). Wir untersuchten daraufhin die Mechanismen, durch die der Metabolismus und insbesondere die Ölbiosynthese an die lokalen Bedingungen innerhalb der einzelnen Organe (Samenschale, Endosperm, inneres und äusseres Keimblatt) angepasst wird (Borisjuk et al, Plant Cell 2013, Lorenz et al., J Proteomics 2014, Schwender et al., Plant Physiology 2015). Zur Zeit charakterisieren wir das überwiegend transiente Endospermgewebe, und untersuchen wie es das Wachstum des sich entwickelnden Embryos beeinflusst.
Trehalose-6‐phosphat (T6P) ist ein pflanzliches Signal für die Zuckerverfügbarkeit. Man nimmt an, dass es auch Speicherprozesse im Samen kontrolliert, da die genetisch-bedingte Unterbrechung der T6P-Synthese in Arabidopsis thaliana zum Abbruch der Embryonalentwicklung führt, und zwar zum Zeitpunkt des Einsetzens der Samenfüllungsphase. Wir untersuchen die Rolle von T6P für die Samenentwicklung anhand transgener Modelle in Erbse: wir modulieren die T6P-Gehalte in Erbsenembryonen durch die ektopische Expression der T6P-Synthase (OtsA) bzw. der T6P-Phosphatase (OtsB) Gene von E. coli. Wir konnten bereits zeigen, daß T6P das Keimblattwachstum sowie die Stärkeakkumulation in reifenden Samen fördert. Diese Prozesse benötigen die transkriptionelle Induktion der Auxinbiosynthese. Unsere Daten zeigen ferner, dass T6P das Auxin-signalling mit der Zuckerverfügbarkeit integriert, und in der Folge die Samenfüllung fördert (Dissertation T. Meitzel 2018; McAdam et al., New Phytologist 2017). Noch sind viele Aspekte hierzu unklar. Daher arbeiten wir derzeit an einer umfassenden Charakterisierung unserer transgenen Modellpflanzen mittel NMR imaging, metabolite profiling und anderen Methoden. Des Weiteren untersuchen wir die Rolle von T6P bei der Samenkeimung und Ölbiosynthese in Brassica napus.
Wir untersuchen die Rolle von programmiertem Zelltod (PCD) in maternalen Samenorganen von Getreiden. Entsprechend unseren Hypothesen spielt PCD eine Rolle für die Kornfüllung, die Entwicklung des Endosperms und letztlich für die Kontrolle der Korngröße. Die Verteilung von TUNEL-positiven Zellkernen, die Expression von PCD-relevanten Genen und die Kaskaden von Caspase-ähnlichen Aktivitäten konnten zeigen, dass jedes Samengewebe einem individuellen PCD-Muster folgt. Bereits in 2006 beschrieben wir das Triticeae-spezifische Gen Jekyll, welches ausschließlich in der nuzellaren Projektion des Korns exprimiert wird. Es ist für die terminale Differenzierung der nuzellaren Gewebe und Umschaltung zum Zelltod verantwortlich (Radchuk et al., Plant Cell 2006). Weiterhin konnten wir feststellen, dass spezifische Gene, welche für das Vacuolar Processing Enzym (VPE) kodieren, für die Entwicklungsmuster des programmierten Zelltods in spezifischen Korngeweben relevant sind. Mittels transcript/metabolite profiling-Methoden, Durchflusszytometrie, Isotopenstudien, Histologie und Kernspintomographie konnten wir zeigen, dass PCD im Perikarp des sich entwickelnden Korns Platz für das expandierende Endosperm und den Embryo schafft (Radchuk et al., New Phytologist 2018). PCD in der nuzellaren Projektion trägt zum Nährstoffzufluss in Richtung Endosperm bei, und wird durch die VPE2-Unterfamilie in Gerste (Mascher et al., Nature 2017) und anderen Triticeae kontrolliert. Zur Zeit untersuchen wir die funktionelle Rolle spezifischer Mitglieder der VPE-Genfamilie.
Die Entwicklungsbiologie untersucht, wie molekulare und zelluläre Prozesse zur Herausbildung 3-dimensionaler, komplexer Organe und Organismen führen. Unsere entwicklungsbiologischen Arbeiten setzen sehr stark auf NMR-Imaging als vielseitiges, analytisches Werkzeug (Borisjuk: “The inner life of seed: from seeing to understanding”, Habilitationsarbeit, Leibniz Universität Hannover/Deutschland 2017). Nuclear Magnetic Resonance Imaging (MRI) arbeitet nicht-invasiv, und kann daher vielfältige, physiologische Prozesse in vivo beobachten. Mittels MRI kann man z.B. das Embryowachstum innerhalb des Samens über längere Zeiträume hinweg untersuchen und dabei verschiedene Parameter wie Größe, Form, Inhaltsstoffe etc. registrieren (Borisjuk et al., Plant J. 2012). Wir haben Methoden entwickelt, um die Blüten- und Samenentwicklung einschließlich spezieller, innerer Stukturen zu verfolgen. Dieser Ansatz wird unterstützt durch z.B. FTIR-basierte Imagingverfahren, welche die Struktur und chemische Zusammensetzung mit nahezu zellulärer, räumlicher Auflösung wiedergeben (Gündel et al., Plant Physiology 2018).
In neueren Arbeiten konnten wir mittels NMR/MRI die Wiedererweckung des Lebens in keimenden Samen beobachten (Munz et al., New Phytologist 2017). Ein holistischer, experimenteller Ansatz erlaubte uns die raumzeitliche Dynamik von Wasseraufnahme, metabolischer Aktivität und strukturellen Änderungen zu untersuchen. So wurde erstmals eine sogenannte „endospermal lipid gap” identifiziert, welche den Wasserzustrom zum Embryo kanalisiert und direkt zur Wurzelspitze leitet. Von hier aus wird das Wasser über das „erwachende“ vaskuläre System des Embryos in Richtung Keimblätter weiter geleitet. Die Wiederaufnahme von Respiration, Zuckermetabolismus und Lipidmobilisierung sind klar mit der raumzeitlichen Sequenz der „Gewebebewässerung“ verbunden.
Mechanosensing
Es ist nahezu unbekannt, ob und wie morphologische Änderungen des Embryos während der Entwicklung den embryonalen Stoffwechsel beeinflussen. So könnte die Krümmung der Embryoachse bzw. der sich entwickelnden Keimblätter die lokalen Wachstumsbedingungen ändern. Es ist unklar, wie der Prozess der embryonalen Formbildung wahrgenommen und in entsprechende metabolische Signale übersetzt wird. Die hierbei beteiligten Prozesse – bezeichnet als mechanosensing und proprioception – werden in laufenden DFG-Projekten am Rapsmodell untersucht. Insbesondere suchen wir nach Mechanismen, wie der wachsende Embryo seine Form und Größe an den verfügbaren Raum (begrenzt durch die Samenschale) anpasst, und wie sich dies in seinem Stoffwechsel reflektiert.
Weitere Modelle, in denen wir Entwicklungsprozesse beschreiben, sind Gerste, Mais, Erbse, und Arabidopsis (Kovalchuk et al., New Phytologist 2016; Radchuk et al., 2018; Lappe et al., PNAS 2018). Darüber hinaus werden o.g. Forschungsansätze und Methoden im Rahmen von Kooperationen mit Züchtern eingesetzt (Raps, Weizen).
Die Entwicklung neuer, bioanalytischer Methoden ist integraler Bestandteil unserer Arbeit in den verschiedenen Projekten. Insbesondere arbeiten wir an: (1) der Verbesserung physikalischer Imaging-Protokolle für NMR/MRI und deren Anwendbarkeit bei Kulturpflanzen; (2) der Entwicklung biochemischer Methoden für Orbitrap-basierte Metabolitanalyse in Mikroproben; (3) der Etablierung von Methoden für die FTIR-Spektroskopie zur Messung von Zuckern und Hormonen; (4) Hochdurchsatzverfahren für die Analyse von Saatgut basierend auf NIRS und TD-NMR einschließlich automatisierter Probengeber.
Beispiele für diese Methodenentwicklung finden sich in Melkus et al., (Plant Biotech J 2011), Fuchs et al. (Plant Physiology 2013), Borisjuk et al. (Plant Cell 2013), Rolletschek et al. (Plant Biotech J 2015), Munz et al. (New Phytologist 2017), und Gündel et al. (Plant Physiology 2018).
scroll top
Mitarbeitende
scroll top
Publikationen
Meitzel T:
Good things come to those who wait - a 42-yr study challenges trade-off theories. New Phytol. 241 (2024) 521-522. https://dx.doi.org/10.1111/nph.19350
Rezaeva B R, Rutten T, Bollmann C, Ortleb S, Melzer M, Kumlehn J:
Plant regeneration via adventitious shoot formation from immature zygotic embryo explants of Camelina. Plants 13 (2024) 465. https://dx.doi.org/10.3390/plants13040465
Rutten T, Thirulogachandar V, Huang Y, Shanmugaraj N, Koppolu R, Ortleb S, Hensel G, Kumlehn J, Melzer M, Schnurbusch T:
Anatomical insights into the vascular lay-out of the barley rachis: implications for transport and spikelet connection. Ann. Bot. (2024) accepted. https://dx.doi.org/10.1093/aob/mcae025
Wamhoff D, Gündel A, Wagner S, Ortleb S, Borisjuk L, Winkelmann T:
Anatomical limitations in adventitious root formation revealed by magnetic resonance imaging, infrared spectroscopy, and histology of rose genotypes with contrasting rooting phenotypes. J. Exp. Bot. (2024) Epub ahead of print. https://dx.doi.org/10.1093/jxb/erae158
Alomari D Z, Schierenbeck M, Alqudah A M, Alqahtani M D, Wagner S, Rolletschek H, Borisjuk L, Röder M S:
Wheat grains as a sustainable source of protein for health. Nutrients 15 (2023) 4398. https://dx.doi.org/10.3390/nu15204398
Bellin L, Melzer M, Hilo A, Amaya D L G, Keller I, Meurer J, Möhlmann T:
Nucleotide limitation results in impaired photosynthesis, reduced growth and seed yield together with massively altered gene expression. Plant Cell Physiol. 64 (2023) 1494-1510. https://dx.doi.org/10.1093/pcp/pcad063
Borisjuk L, Horn P, Chapman K, Jakob P M, Gündel A, Rolletschek H:
Seeing plants as never before. New Phytol. 238 (2023) 1775-1794. https://dx.doi.org/10.1111/nph.18871
Gündel A:
Multimodal imaging unveils the hidden dimensions of plant physiology: from metabolic landscapes to mechanistic insights. (PhD Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2023) 240 pp.
Keil P, Gündel B, Gündel A, Rolletschek H, Borisjuk L:
Non-invasive single-grain screening of proteins and other features by combination of near-infrared spectroscopy and nuclear magnetic resonance. Agronomy 13 (2023) 1393. https://dx.doi.org/10.3390/agronomy13051393
Langer M, Hilo A, Guan J-C, Koch K E, Xiao H, Verboven P, Gündel A, Wagner S, Ortleb S, Radchuk V, Mayer S, Nicolai B, Borisjuk L, Rolletschek H:
Causes and consequences of endogenous hypoxia on growth and metabolism of developing maize kernels. Plant Physiol. 192 (2023) 1268-1288. https://dx.doi.org/10.1093/plphys/kiad038
Mira M M, Hill R D, Hilo A, Langer M, Robertson S, Igamberdiev A U, Wilkins O, Rolletschek H, Stasolla C:
Plant stem cells under low oxygen: metabolic rewiring by phytoglobin underlies stem cell functionality. Plant Physiol. 193 (2023) 1416-1432. https://dx.doi.org/10.1093/plphys/kiad344
Plutenko I, Papkov M, Palo K, Parts L, Fishman D:
Metadata improves segmentation through multitasking elicitation. In: Koch L, Cardoso M J, Ferrante E, Kamnitsas K, Islam M, Jiang M, Rieke N, Tsaftaris S A, Yang D (Eds.): Domain adaptation and representation transfer. DART 2023. (Series: Lecture Notes in Computer Science, Vol. 14293) Cham: Springer (2023) ISBN 978-3-319-23107-5, 147-155. https://dx.doi.org/10.1007/978-3-031-45857-6_15
Radchuk V, Belew Z M, Gündel A, Mayer S, Hilo A, Hensel G, Sharma R, Neumann K, Ortleb S, Wagner S, Muszynska A, Crocoll C, Xu D, Hoffie I, Kumlehn J, Fuchs J, Peleke F F, Szymanski J J, Rolletschek H, Nour-Eldin H H, Borisjuk L:
SWEET11b transports both sugar and cytokinin in developing barley grains. Plant Cell 35 (2023) 2186-2207. https://dx.doi.org/10.1093/plcell/koad055
Shi H, Ernst E, Heinzel N, McCorkle S, Rolletschek H, Borisjuk L, Ortleb S, Martienssen R, Shanklin J, Schwender J:
Mechanisms of metabolic adaptation in the duckweed Lemna gibba: an integrated metabolic, transcriptomic and flux analysis. BMC Plant Biol. 23 (2023) 458. https://dx.doi.org/10.1186/s12870-023-04480-9
Teh J T, Leitz V, Holzer V J C, Neusius D, Marino G, Meitzel T, García-Cerdán J G, Dent R M, Niyogi K K, Geigenberger P, Nickelsen J:
NTRC regulates CP12 to activate Calvin-Benson cycle during cold acclimation. Proc. Natl. Acad. Sci. U.S.A. 120 (2023) e2306338120. https://dx.doi.org/10.1073/pnas.2306338120
Blume R Y, Yemets A I, Korkhovyi V, Radchuk V, Rakhmetov D, Blume Y B:
Genome-wide identification and analysis of cytokinin oxidase/dehydrogenase (ckx) gene family in finger millet (Eleusine coracana) Front. Genet. 13 (2022) 963789. https://dx.doi.org/10.3389/fgene.2022.963789
Bouquet F:
Mechanismen der molekularen und biochemischen Anpassung zu Hypoxie in Maissamen. (Master Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät, Institut für Pflanzengenetik (2022)
Mayer S, Munz E, Hammer S, Wagner S, Guendel A, Rolletschek H, Jakob P M, Borisjuk L, Neuberger T:
Quantitative monitoring of paramagnetic contrast agents and their allocation in plant tissues via DCE-MRI. Plant Methods 18 (2022) 47. https://dx.doi.org/10.1186/s13007-022-00877-z
Nagel M, Arc E, Rajjou L, Cueff G, Bailly M, Clément G, Sanchez-Vicente I, Bailly C, Seal C E, Roach T, Rolletschek H, Lorenzo O, Börner A, Kranner I:
Impacts of drought and elevated temperature on the seeds of malting barley. Front. Plant Sci. 13 (2022) 1049323. https://dx.doi.org/10.3389/fpls.2022.1049323
Plaehn N M J, Mayer S, Jakob P M, Gutjahr F T:
T1-independent exchange rate quantification using saturation- or phase sensitive-water exchange spectroscopy. J. Magn. Reson. 335 (2022) 107141. https://dx.doi.org/10.1016/j.jmr.2021.107141
Schüler V J:
Analyse des Interaktionsmechanismus des Nuclear Factor Y Komplexes in Gerstenkörnern. (Bachelor Thesis) Köthen, Hochschule Anhalt, Fachbereich Angewandte Biowissenschaften und Prozesstechnik (2022) 61 pp.
Acosta K, Appenroth K J, Borisjuk L, Edelman M, Heinig U, Jansen M A K, Oyama T, Pasaribu B, Schubert I, Sorrels S, Sree K S, Xu S, Michael T P, Lam E:
Return of the Lemnaceae: Duckweed as a model plant system in the genomics and post-genomics era. Plant Cell 33 (2021) 3207-3234. https://dx.doi.org/10.1093/plcell/koab189
Fiebelkow J, Guendel A, Guendel B, Mehwald N, Jetka T, Komorowski M, Waldherr S, Schaper F, Dittrich A:
The tyrosine phosphatase SHP2 increases robustness and information transfer within IL-6-induced JAK/STAT signalling. Cell Commun. Signal. 19 (2021) 94. https://dx.doi.org/10.1186/s12964-021-00770-7
Goelckel L:
Cellular plasticity and mechanosensing in the Brassica napus embryo. (Master Thesis) Halle/S., Martin-Luther-Universität Halle-Wittenberg, Naturwissenschaftliche Fakultät I Biowissenschaften, Institut für Biologie (2021) 61 pp.
Gomez-Sanchez A, Santamaria M E, Gonzalez-Melendi P, Muszynska A, Matthess C, Martinez M, Diaz I:
Repression of barley cathepsins, HvPap-19 and HvPap-1, differentially alters grain composition and delays germination. J. Exp. Bot. 72 (2021) 3474-3485. https://dx.doi.org/10.1093/jxb/erab007
Guendel A, Hilo A, Rolletschek H, Borisjuk L:
Probing the metabolic landscape of plant vascular bundles by infrared fingerprint analysis, imaging and mass spectrometry. Biomolecules 11 (2021) 1717. https://dx.doi.org/10.3390/biom11111717
Meitzel T, Radchuk R, McAdam E L, Thormählen I, Feil R, Munz E, Hilo A, Geigenberger P, Ross J J, Lunn J E, Borisjuk L:
Trehalose 6-phosphate promotes seed filling by activating auxin biosynthesis. New Phytol. 229 (2021) 1553-1565. https://dx.doi.org/10.1111/nph.16956
Michael T P, Ernst E, Hartwick N, Chu P, Bryant D, Gilbert S, Ortleb S, Baggs E L, Sree K S, Appenroth K J, Fuchs J, Jupe F, Sandoval J P, Krasileva K V, Borisjuk L, Mockler T C, Ecker J, Martienssen R A, Lam E:
Genome and time-of-day transcriptome of Wolffia australiana link morphological minimization with gene loss and less growth control. Genome Res. 31 (2021) 225-238. https://dx.doi.org/10.1101/gr.266429.120
Muszynska A, Guendel A, Melzer M, Tandrón Moya Y, Röder M, Rolletschek H, Rutten T, Munz E, Melz G, Ortleb S, Borisjuk L, Börner A:
A mechanistic view on lodging resistance in rye and wheat: a multiscale comparative study. Plant Biotechnol. J. 19 (2021) 2646-2661. https://dx.doi.org/10.1111/pbi.13689
Radchuk V, Tran V, Hilo A, Muszynska A, Gündel A, Wagner S, Fuchs J, Hensel G, Ortleb S, Munz E, Rolletschek H, Borisjuk L:
Grain filling in barley relies on developmentally controlled programmed cell death. Commun. Biol. 4 (2021) 428. https://dx.doi.org/10.1038/s42003-021-01953-1
Rolletschek H:
Hardy Rolletschek. New Phytol. 232 (2021) 476-478. https://dx.doi.org/10.1111/nph.17567
Rolletschek H, Mayer S, Boughton B, Wagner S, Ortleb S, Kiel C, Roessner U, Borisjuk L:
The metabolic environment of the developing embryo: A multidisciplinary approach on oilseed rapeseed. J. Plant Physiol. 265 (2021) 153505. https://dx.doi.org/10.1016/j.jplph.2021.153505
Rolletschek H, Muszynska A, Borisjuk L:
The process of seed maturation is influenced by mechanical constraints. New Phytol. 229 (2021) 19-23. https://dx.doi.org/10.1111/nph.16815
Vogelsang N:
A novel sensor to map the trehalose 6-phosphate distribution in planta. (Bachelor Thesis) Köthen, Hochschule Anhal (2021) 43 pp.
Borisjuk L, Rolletschek H, Radchuk V:
Advances in understanding of barley plant physiology: factors determining grain development and composition/chemistry. In: Fox G, Li C (Eds.): Achieving sustainable cultivation of barley. (Burleigh Dodds Series in Agricultural Science, Vol. 74) Cambridge, UK: Burleigh Dodds (2020) ISBN 978-1-78676-308-2, 53-96. https://dx.doi.org/10.19103/AS.2019.0060.03
Impe D, Reitz J, Köpnick C, Rolletschek H, Börner A, Senula A, Nagel M:
Assessment of pollen viability for wheat. Front. Plant Sci. 10 (2020) 1588. https://dx.doi.org/10.3389/fpls.2019.01588
Isayenkov S, Hilo A, Rizzo P, Tandron Moya Y A, Rolletschek H, Borisjuk L, Radchuk V:
Adaptation strategies of halophytic barley Hordeum marinum spp marinum to high salinity and osmotic stress. Int. J. Mol. Sci. 21 (2020) 9019. https://dx.doi.org/10.3390/ijms21239019
Le H, Nguyen N H, Ta D T, Le T N T, Bui T P, Le N T, Nguyen C X, Rolletschek H, Stacey G, Stacey M G, Pham N B, Do P T, Chu H H:
CRISPR/Cas9-mediated knockout of galactinol synthase-encoding genes reduces raffinose family oligosaccharide levels in soybean seeds. Front. Plant Sci. 11 (2020) 612942. https://dx.doi.org/10.3389/fpls.2020.612942
Rolletschek H, Schwender J, König C, Chapman K D, Romsdahl T, Lorenz C, Braun H P, Denolf P, van Audenhove K, Munz E, Heinzel N, Ortleb S, Rutten T, McCorkle S, Borysyuk T, Gündel A, Shi H, Vander Auwermeulen M, Bourot S, Borisjuk L:
Cellular plasticity in response to suppression of storage proteins in the Brassica napus embryo. Plant Cell 32 (2020) 2383-2401. https://dx.doi.org/10.1105/tpc.19.00879
Stickel F:
Phänotypische, biochemische und molekulare Untersuchungen von Hordeum vulgare mit modulierter Expression von SWEET-Transportern. (Bachelor Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2020) 90 pp.
Sturtevant D, Lu S, Zhou Z W, Shen Y, Wang S, Song J M, Zhong J, Burks D J, Yang Z Q, Yang Q Y, Cannon A E, Herrfurth C, Feussner I, Borisjuk L, Munz E, Verbeck G F, Wang X, Azad R K, Singleton B, Dyer J M, Chen L L, Chapman K D, Guo L:
The genome of jojoba (Simmondsia chinensis): A taxonomically isolated species that directs wax ester accumulation in its seeds. Sci. Adv. 6 (2020) eaay3240. https://dx.doi.org/10.1126/sciadv.aay3240
Tikhenko N, Alqudah A M, Borisjuk L, Ortleb S, Rutten T, Wu D D, Nagel M, Himmelbach A, Mascher M, Röder M, Ganal M, Sehmisch S, Houben A, Börner A:
DEFECTIVE ENDOSPERM-D1 (Dee-D1) is crucial for endosperm development in hexaploid wheat. Commun. Biol. 3 (2020) 791. https://doi.org/10.1038/s42003-020-01509-9
Druege U, Hilo A, Pérez-Pérez J M, Klopotek Y, Acosta M, Shahinnia F, Zerche S, Franken P, Hajirezaei M R:
Molecular and physiological control of adventitious rooting in cuttings: phytohormone action meets resource allocation. Ann. Bot. 123 (2019) 929–949. https://dx.doi.org/10.1093/aob/mcy234
Gündel A, Rolletschek H, Borisjuk L:
Infrared visualization of sucrose in plants. A novel microspectroscopic method allows sugar mapping across the plant tissue. q-more.chemeurope.com/q-more-articles/279/infrared-visualization-of-sucrose-in-plants.html. (2019)
Gündel A, Rolletschek H, Wagner S, Muszynska A, Borisjuk L:
More insights with infrared. New method enables quantitative visualization of sucrose distribution in plants. Imaging & Microscopy 1 (2019) 28-29.
Gündel A, Rolletschek H, Wagner S, Muszynska A, Borisjuk L:
Mehr sehen mit Infrarot – Quantitative Visualisierung der Saccharose-Verteilung in Pflanzen. GIT Labor-Fachzeitschr. 63 (2019) 38-39.
Gutjahr F T, Munz E, Jakob P M:
Positive chemical exchange contrast in MRI using Refocused Acquisition of Chemical Exchange Transferred Excitations (RACETE). Z. Med. Phys. 29 (2019) 184-191. https://dx.doi.org/10.1016/j.zemedi.2018.05.005
Langer M:
Untersuchungen zur Samenentwicklung bei Cyclamen persicum MILL. – Visualisierung über NMR sowie Lipid- und Phytohormonanalysen. (Master Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2019) 126 pp.
Radchuk V, Sharma R, Potokina E, Radchuk R, Weier D, Munz E, Schreiber M, Mascher M, Stein N, Wicker T, Kilian B, Borisjuk L:
The highly divergent Jekyll genes, required for sexual reproduction, are lineage specific for the related grass tribes Triticeae and Bromeae. Plant J. 98 (2019) 961-974. https://dx.doi.org/10.1111/tpj.14363
Rizzo P, Altschmied L, Stark P, Rutten T, Guendel A, Scharfenberg S, Franke K, Baeumlein H, Wessjohann L, Koch M, Borisjuk L, Sharbel T F:
Discovery of key regulators of dark glands development and hypericin biosynthesis in St. Johns wort (Hypericum perforatum). Plant Biotechnol. J. 17 (2019) 2299-2312. https://dx.doi.org/10.1111/pbi.13141
Savchenko T, Rolletschek H, Dehesh K:
Jasmonates-mediated rewiring of central metabolism regulates adaptive responses. Plant Cell Physiol. 60 (2019) 2613-2620. https://dx.doi.org/10.1093/pcp/pcz181
Savchenko T, Rolletschek H, Heinzel N, Tikhonov K, Dehesh K:
Waterlogging tolerance rendered by oxylipin-mediated metabolic reprogramming in Arabidopsis. J. Exp. Bot. 70 (2019) 2919–2932. https://dx.doi.org/10.1093/jxb/erz110
Tedeschi F, Rizzo P, Huong B, Czihal A, Rutten T, Altschmied L, Scharfenberg S, Grosse I, Becker C, Weigel D, Bäumlein H, Kuhlmann M:
EFFECTOR OF TRANSCRIPTION factors are novel plant-specific regulators associated with genomic DNA methylation in Arabidopsis. New Phytol. 221 (2019) 261-278. https://dx.doi.org/10.1111/nph.15439
Wabila C, Neumann K, Kilian B, Radchuk V, Graner A:
A tiered approach to genome-wide association analysis for the adherence of hulls to the caryopsis of barley seeds reveals footprints of selection. BMC Plant Biol. 19 (2019) 95. https://dx.doi.org/10.1186/s12870-019-1694-1
Zornow R:
Untersuchungen zum Keimverhalten von Getreide- und Ölsaaten. (Master Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2019) 99 pp.
Gündel A, Rolletschek H, Wagner S, Muszynska A, Borisjuk L:
Micro imaging displays the sucrose landscape within and along its allocation pathways. Plant Physiol. 178 (2018) 1448-1460. https://dx.doi.org/10.1104/pp.18.00947
Lappe R R, Baier J W, Boehlein S K, Huffman R, Lin Q, Wattebled F, Settles A M, Hannah L C, Borisjuk L, Rolletschek H, Stewart J D, Scott M P, Hennen-Bierwagen T A, Myers A M:
Functions of maize genes encoding pyruvate phosphate dikinase in developing endosperm. Proc. Natl. Acad. Sci. U.S.A. 115 (2018) E24-E33. https://dx.doi.org/10.1073/pnas.1715668115
Lorenz C, Brandt S, Borisjuk L, Rolletschek H, Heinzel N, Tohge T, Fernie A R, Braun H-P, Hildebrandt T M:
The role of persulfide metabolism during Arabidopsis seed development under light and dark conditions. Front. Plant Sci. 9 (2018) 1381. https://dx.doi.org/10.3389/fpls.2018.01381
Meitzel T:
Signaling pathways in legume seed development: evidence for a crosstalk between trehalose 6-phosphate and auxin. (PhD Thesis) Halle/S., Martin-Luther-Universität Halle-Wittenberg, Naturwissenschaftliche Fakultät I Biowissenschaften (2018) 177 pp.
Munz E:
High resolution, physiological and metabolic MRI of plants. (PhD Thesis) Würzburg, Julius-Maximilians-Universität (2018) 170 pp.
Muszynska A:
Histological, ultrastructural, elemental, and molecular genetic characterization of ′Stabilstroh’, a complex trait of rye (Secale cereale L.) determining lodging resistance. (PhD Thesis) Halle/S., Martin-Luther-Universität Halle-Wittenberg, Naturwissenschaftliche Fakultät III Agrar- und Ernährungswissenschaften, Geowissenschaften und Informatik (2018) 161 pp.
Radchuk V, Tran V, Radchuk R, Diaz-Mendoza M, Weier D, Fuchs J, Riewe D, Hensel G, Kumlehn J, Munz E, Heinzel N, Rolletschek H, Martinez M, Borisjuk L:
Vacuolar processing enzyme 4 contributes to maternal control of grain size in barley by executing programmed cell death in the pericarp. New Phytol. 218 (2018) 1127-1142. https://dx.doi.org/10.1111/nph.14729
Rajaraman J, Douchkov D, Lück S, Hensel G, Nowara D, Pogoda M, Rutten T, Meitzel T, Brassac J, Höfle C, Hückelhoven R, Klinkenberg J, Trujillo M, Bauer E, Schmutzer T, Himmelbach A, Mascher M, Lazzari B, Stein N, Kumlehn J, Schweizer P:
Evolutionarily conserved partial gene duplication in the Triticeae tribe of grasses confers pathogen resistance. Genome Biol. 19 (2018) 116. https://dx.doi.org/10.1186/s13059-018-1472-7
Walerowski P, Gündel A, Yahaya N, Truman W, Sobczak M, Olszak M, Rolfe S A, Borisjuk L, Malinowski R:
Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. Plant Cell 30 (2018) 3058-3073. https://dx.doi.org/10.1105/tpc.18.00283
Borisjuk L:
The inner life of seed: from seeing to understanding. (Habilitation Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2017) 402 pp.
Keil P, Liebsch G, Borisjuk L, Rolletschek H:
MultiSense: a multimodal sensor tool enabling the high throughput analysis of respiration. In: Kapuganti J G (Ed.): Plant respiration and internal oxygen: methods and protocols. (Series: Methods in molecular biology, Vol. 1670) New York, NY [u.a.]: Humana Press (2017) ISBN 978-1-4939-7291-3, 47-56. https://dx.doi.org/10.1007/978-1-4939-7292-0_5
König C:
Molecular and metabolic characterization of assimilate uptake and storage product synthesis in Brassica napus. (PhD Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2017) 119 pp.
Mascher M, Gundlach H, Himmelbach A, Beier S, Twardziok S O, Wicker T, Radchuk V, Dockter C, Hedley P E, Russell J, Bayer M, Ramsay L, Liu H, Haberer G, Zhang X-Q, Zhang Q, Barrero R A, Li L, Taudien S, Groth M, Felder M, Hastie A, Šimková H, Staňková H, Vrána J, Chan S, Muñoz-Amatriaín M, Ounit R, Wanamaker S, Bolser D, Colmsee C, Schmutzer T, Aliyeva-Schnorr L, Grasso S, Tanskanen J, Chailyan A, Sampath D, Heavens D, Clissold L, Cao S, Chapman B, Dai F, Han Y, Li H, Li X, Lin C, McCooke J K, Tan C, Wang P, Wang S, Yin S, Zhou G, Poland J A, Bellgard M I, Borisjuk L, Houben A, Doležel J, Ayling S, Lonardi S, Kersey P, Langridge P, Muehlbauer G J, Clark M D, Caccamo M, Schulman A H, Mayer K F X, Platzer M, Close T J, Scholz U, Hansson M, Zhang G, Braumann I, Spannagl M, Li C, Waugh R, Stein N:
A chromosome conformation capture ordered sequence of the barley genome. Nature 544 (2017) 427-433. https://dx.doi.org/10.1038/nature22043
McAdam E L, Meitzel T, Quittenden L J, Davidson S E, Dalmais M, Bendahmane A I, Thompson R, Smith J J, Nichols D S, Urquhart S, Gélinas-Marion A, Aubert G, Ross J J:
Evidence that auxin is required for normal seed size and starch synthesis in pea. New Phytol. 216 (2017) 193-204. https://dx.doi.org/10.1111/nph.14690
Munz E, Rolletschek H, Oeltze-Jafra S, Fuchs J, Guendel A, Neuberger T, Ortleb S, Jakob P M, Borisjuk L:
A functional imaging study of germinating oilseed rape seed. New Phytol. 216 (2017) 1181-1190. https://dx.doi.org/10.1111/nph.14736
Radchuk V, Riewe D, Peukert M, Matros A, Strickert M, Radchuk R, Weier D, Steinbiß H-H, Sreenivasulu N, Weschke W, Weber H:
Down-regulated sucrose transporters HvSUT1, HvSUT2 affects sucrose homeostasis along its delivery path in barley grains. J. Exp. Bot. 68 (2017) 4595-4612. https://doi.org/10.1093/jxb/erx266
Reichelt W N, Brillmann M, Thurrold P, Keil P, Fricke J, Herwig C:
Physiological capacities decline during induced bioprocesses leading to substrate accumulation. In: Ferreira G N M, Glassey J (Eds.): Biotechnol. J. (Special Issue: European Symposium on Biochemical Engineering Science, Dublin 2016). (Vol. 7) : WILEY-VCH Verlag (2017) 1860-7314, 1600547. https://dx.doi.org/10.1002/biot.201600547
Rolletschek H, Borisjuk L, Hennen-Bierwagen T A, Myers A M:
Central metabolism and its spatial heterogeneity in maize endosperm. In: Larkins B A (Ed.): Maize kernel development. Boston, MA: CABI (2017) ISBN 978-1-78639-121-6, 134-148.
Rolletschek H, Liebsch G:
A method for imaging oxygen distribution and respiration at a microscopic level of resolution. In: Kapuganti J G (Ed.): Plant respiration and internal oxygen: methods and protocols. (Series: Methods in molecular biology, Vol. 1670) New York, NY [u.a.]: Humana Press (2017) ISBN 978-1-4939-7291-3, 31-38. https://dx.doi.org/10.1007/978-1-4939-7292-0_3
Scherzer S, Shabala L, Hedrich B, Fromm J, Bauer H, Munz E, Jakob P, Al-Rascheid K A S, Kreuzer I, Becker D, Eiblmeier M, Rennenberg H, Shabala S, Bennett M, Neher E, Hedrich R:
Insect haptoelectrical stimulation of Venus flytrap triggers exocytosis in gland cells. Proc. Natl. Acad. Sci. U.S.A. 114 (2017) 4822-4827. https://dx.doi.org/10.1073/pnas.1701860114
Woodfield H K, Sturtevant D, Borisjuk L, Munz E, Guschina I A, Chapman K D, Harwood J L:
Spatial and temporal mapping of key lipid species in Brassica napus seeds. Plant Physiol. 173 (2017) 1998-2009. https://dx.doi.org/10.1104/pp.16.01705
Keller E R J, Grübe M, Hajirezaei M-R, Melzer M, Mock H-P, Rolletschek H, Senula A, Subbarayan K:
Experience in large-scale cryopreservation and links to applied research for safe storage of plant germplasm. In: Lambardi M, Hamill S (Eds.): Proceedings of the XXIX IHC - Int. Symp. on Micropropagation and In Vitro Techniques, Brisbane, Australia, August 17-22, 2014. (Series: Acta Horticulturae, Vol. 1113) Leuven: ISHS (2016) 239-249. https://dx.doi.org/10.17660/ActaHortic.2016.1113.36
Kovalchuk N, Chew W, Sornaraj P, Borisjuk N, Yang N, Singh R, Bazanova N, Shavrukov Y, Guendel A, Munz E, Borisjuk L, Langridge P, Hrmova M, Lopato S:
The homeodomain transcription factor TaHDZipI-2 from wheat regulates frost tolerance, flowering time and spike development in transgenic barley. New Phytol. 211 (2016) 671-687. https://dx.doi.org/10.1111/nph.13919
Munz E, Jakob P M, Borisjuk L:
The potential of nuclear magnetic resonance to track lipids in planta. Biochimie 130 (2016) 97-108. https://dx.doi.org/10.1016/j.biochi.2016.07.014
Fuchs J, Melkus G, Borisjuk L, Jakob P:
Tracking metabolite dynamics in plants via indirect 13C chemical shift imaging with an interleaved variable density acquisition weighted sampling pattern. Magn. Reson. Mat. Phys. 28 (2015) 127-134. https://dx.doi.org/10.1007/s10334-014-0453-4
Nagel M, Kranner I, Neumann K, Rolletschek H, Seal C E, Colville L, Fernández-Marín B, Börner A:
Genome-wide association mapping and biochemical markers reveal that seed ageing and longevity are intricately affected by genetic background, developmental and environmental conditions in barley. Plant Cell Environ. 38 (2015) 1011-1022. https://dx.doi.org/10.1111/pce.12474
Rolletschek H, Fuchs J, Friedel S, Börner A, Todt H, Jakob P, Borisjuk L:
A novel noninvasive procedure for high-throughput screening of major seed traits. Plant Biotechnol. J. 13 (2015) 188-199. https://dx.doi.org/10.1111/pbi.12245
Rolletschek H, Grafahrend-Belau E, Munz E, Radchuk V V, Kartäusch R, Tschiersch H, Melkus G, Schreiber F, Jakob P M, Borisjuk L:
Metabolic architecture of the cereal grain and its relevance to maximize carbon use efficiency. Plant Physiol. 169 (2015) 1698-1713. https://dx.doi.org/10.1104/pp.15.00981
Schwender J, Hebbelmann I, Heinzel N, Hildebrandt T M, Rogers A, Naik D, Klapperstück M, Braun H P, Schreiber F, Denolf P, Borisjuk L, Rolletschek H:
Quantitative multilevel analysis of central metabolism in developing oilseeds of Brassica napus during in vitro culture. Plant Physiol. 168 (2015) 828-848. https://dx.doi.org/10.1104/pp.15.00385
Subbarayan K, Rolletschek H, Senula A, Ulagappan K, Hajirezaei M-R, Keller E R J:
Influence of oxygen deficiency and the role of specific amino acids in cryopreservation of garlic shoot tips. BMC Biotechnol. 15 (2015) 40. https://dx.doi.org/10.1186/s12896-015-0171-7
Thormählen I, Meitzel T, Groysman J, Öchsner A B, von Roepenack-Lahaye E, Naranjo B, Cejudo F J, Geigenberger P:
Thioredoxin f1 and NADPH-dependent thioredoxin reductase C have overlapping functions in regulating photosynthetic metabolism and plant growth in response to varying light conditions. Plant Physiol. 169 (2015) 1766-1786. https://dx.doi.org/10.1104/pp.15.01122
Borisjuk L, Melkus G:
Nuclear magnetic resonance imaging of metabolites in plants and animals. In: Hough R, Camarillo J (Eds.): In vivo imaging: new research. New York: Nova Science Publishers (2014) ISBN 978-1-62948-633-8, 1-48.
Hay J O, Shi H, Heinzel N, Hebbelmann I, Rolletschek H, Schwender J:
Integration of a constraint-based metabolic model of Brassica napus developing seeds with (13)C-metabolic flux analysis. Front. Plant Sci. 5 (2014) 724. https://dx.doi.org/10.3389/fpls.2014.00724
Lorenz C, Rolletschek H, Sunderhaus S, Braun H P:
Brassica napus seed endosperm - metabolism and signaling in a dead end tissue. J. Proteomics 108 (2014) 382-426. https://dx.doi.org/10.1016/j.jprot.2014.05.024
Radchuk V, Borisjuk L:
Physical, metabolic and developmental functions of the seed coat. Front. Plant Sci. 5 (2014) 510. https://dx.doi.org/10.3389/fpls.2014.00510
Radchuk V, Pirko Y V, Isayenkov S V, Yemets A I, Blume Y B:
cDNA library construction from meristematic tissue of finger millet panicle. Cytol. Genet. 48 (2014) 273-278. https://dx.doi.org/10.3103/S0095452714050089
Schwender J, König C, Klapperstück M, Heinzel N, Munz E, Hebbelmann I, Hay J O, Denolf P, de Bodt S, Redestig H, Caestecker E, Jakob P M, Borisjuk L, Rolletschek H:
Transcript abundance on its own cannot be used to infer fluxes in central metabolism. Front. Plant Sci. 5 (2014) 668. https://dx.doi.org/10.3389/fpls.2014.00668
Tran V, Weier D, Radchuk R, Thiel J, Radchuk V:
Caspase-like activities accompany programmed cell death events in developing barley grains. PLoS One 9 (2014) e109426. https://dx.doi.org/10.1371/journal.pone.0109426
Tschiersch H, Liebsch G, Borisjuk L, Stangelmayer A, Rolletschek H:
Imaging microbial culture O2 consumption: metabolic activity of E. coli monitored inside the incubator with the VisiSens™ A1. Genet. Engin. Biotechnol. News 34 (2014) 30. https://dx.doi.org/10.1089/gen.34.14.15
Borisjuk L:
Looking into plant life. International Innovation 10 (2013) 79.
Borisjuk L, Neuberger T, Schwender J, Heinzel N, Sunderhaus S, Fuchs J, Hay J O, Tschiersch H, Braun H P, Denolf P, Lambert B, Jakob P M, Rolletschek H:
Seed architecture shapes embryo metabolism in oilseed rape. Plant Cell 25 (2013) 1625-1640. https://dx.doi.org/10.1105/tpc.113.111740
Borisjuk L, Rolletschek H, Jakob P:
Visualizing the feature of plant science. International Innovation 10 (2013) 80-81.
Borisjuk L, Rolletschek H, Neuberger T:
Nuclear magnetic resonance imaging of lipid in living plants. Prog. Lipid Res. 52 (2013) 465-487. https://dx.doi.org/10.1016/j.plipres.2013.05.003
Fuchs J, Neuberger T, Rolletschek H, Schiebold S, Nguyen T H, Borisjuk N, Börner A, Melkus G, Jakob P, Borisjuk L:
A non-invasive platform for imaging and quantifying oil storage in sub-millimetre tobacco seed[W][OA]. Plant Physiol. 161 (2013) 583-593. https://dx.doi.org/10.1104/pp.112.210062
Gupta K J, Rolletschek H:
Plant respiratory metabolism: a special focus on the physiology of beetroot (Beta vulgaris) mitochondria. In: Neelwarne B (Ed.): Red beet biotechnology: food and pharmaceutical applications. New York [u.a.]: Springer (2013) ISBN 978-1-4614-3457-3, 91-104. https://dx.doi.org/10.1007/978-1-4614-3458-0_5
Horn P J, Silva J E, Anderson D, Fuchs J, Borisjuk L, Nazarenus T J, Shulaev V, Cahoon E B, Chapman K D:
Imaging heterogeneity of membrane and storage lipids in transgenic Camelina sativa seeds with altered fatty acid profiles. Plant J. 76 (2013) 138-150. https://dx.doi.org/10.1111/tpj.12278
Kalladan R, Worch S, Rolletschek H, Harshavardhan V T, Kuntze L, Seiler C, Sreenivasulu N, Röder M S:
Identification of quantitative trait loci contributing to yield and seed quality parameters under terminal drought in barley advanced backcross lines. Mol. Breed. 32 (2013) 71-99. https://dx.doi.org/10.1007/s11032-013-9853-9
Kim Y M, Heinzel N, Giese J O, Koeber J, Melzer M, Rutten T, von Wirén N, Sonnewald U, Hajirezaei M-R:
A dual role of tobacco hexokinase 1 in primary metabolism and sugar sensing. Plant Cell Environ. 36 (2013) 1311-1327. https://dx.doi.org/10.1111/pce.12060
Verboven P, Herremans E, Borisjuk L, Helfen L, Ho Q T, Tschiersch H, Fuchs J, Nicolai B M, Rolletschek H:
Void space inside the developing seed of Brassica napus and the modelling of its function. New Phytol. 199 (2013) 936-947. https://dx.doi.org/10.1111/nph.12342
Borisjuk L, Rolletschek H, Neuberger T:
Surveying the plants world by magnetic resonance imaging. Plant J. 70 (2012) 129-146. https://dx.doi.org/10.1111/j.1365-313X.2012.04927.x
Faix B, Radchuk V, Nerlich A, Hümmer C, Radchuk R, Emery R J, Keller H, Götz K P, Weschke W, Geigenberger P, Weber H:
Barley grains, deficient in cytosolic small subunit of ADP-glucose pyrophosphorylase, reveal coordinate adjustment of C:N metabolism mediated by an overlapping metabolic-hormonal control. Plant J. 69 (2012) 1077-1093. https://dx.doi.org/10.1111/j.1365-313X.2011.04857.x
Horn P J, Korte A R, Neogi P B, Love E, Fuchs J, Strupat K, Borisjuk L, Shulaev V, Lee Y J, Chapman K D:
Spatial mapping of lipids at cellular resolution in embryos of cotton. Plant Cell 24 (2012) 622-636. https://dx.doi.org/10.1105/tpc.111.094581
Kaur H, Shaker K, Heinzel N, Ralph J, Galis I, Baldwin I T:
Environmental stresses of field growth allow cinnamyl alcohol dehydrogenase-deficient Nicotiana attenuata plants to compensate for their structural deficiencies. Plant Physiol. 159 (2012) 1545-1570. https://dx.doi.org/10.1104/pp.112.196717
Radchuk V, Kumlehn J, Rutten T, Sreenivasulu N, Radchuk R, Rolletschek H, Herrfurth C, Feussner I, Borisjuk L:
Fertility in barley flowers depends on Jekyll functions in male and female sporophytes. New Phytol. 194 (2012) 142-157. https://dx.doi.org/10.1111/j.1469-8137.2011.04032.x
Rolletschek H:
Hypoxia – a phenomenon which shapes seed metabolism. (Habilitation Thesis) Hannover, Gottfried Wilhelm Leibniz Universität Hannover, Naturwissenschaftliche Fakultät (2012) 286 pp.
Tschiersch H, Liebsch G, Borisjuk L, Stangelmayer A, Rolletschek H:
An imaging method for oxygen distribution, respiration and photosynthesis at a microscopic level of resolution. New Phytol. 196 (2012) 926-936. https://dx.doi.org/10.1111/j.1469-8137.2012.04295.x
scroll top